Este año hemos vuelto a hacer figuritas de mazapán, y la sección "microbiológica" se ha dedicado a recrear algunos de los dibujos de la serie Moyashimon.
Los seres vivos son a las leyes de la Termodinámica lo que los abogados son a las leyes de la sociedad
Bienvenidos. Este blog está dedicado a la Microbiología pero en general cualquier tema científico de interés tambien puede aparecer. El contenido de este blog es estrictamente científico y docente, por lo que no es un consultorio de salud. No estoy ni capacitado ni autorizado para responder a consultas de carácter médico-sanitario que expongan casos personales. Las imágenes que aparecen están sacadas de sitios públicos de la web y se indica su origen o basta cliquear sobre ellas para saberlo, pero si hay algún problema de copyright, por favor indicarlo en comentarios y se retirarán.
Para ir al blog de PROBLEMAS DE MICROBIOLOGIA o al PODCAST DEL MICROBIO , pincha sobre el nombre.
miércoles, 31 de diciembre de 2014
Mazapán microbiológico - 2
Este año hemos vuelto a hacer figuritas de mazapán, y la sección "microbiológica" se ha dedicado a recrear algunos de los dibujos de la serie Moyashimon.
jueves, 11 de diciembre de 2014
Cine y bichos: Interstellar
 |
| Origen de la imagen: Wikipedia |
En cierta forma pasó eso, pero no precisamente por lo que yo creía. La película es espectacular y los efectos especiales son muy originales. La trama no esta mal aunque me pareció algo larga (le sobra una hora). La doy un notable. La decepción tuvo que ver con otra cosa. En cuanto a la credibilidad científica, pues... la Física Relativista puede ser buena, pero la Biología y la Química no.
No voy a entrar en aspectos tales como que para salir de la Tierra necesiten un cohete de tres etapas y luego aparezcan con una pequeña nave capaz de salir de un planeta con una gravedad mayor, y que además sea capaz de aguantar una ola gigantesca. Ni tampoco me voy a meter en que tipo de comida liofilizada, ni que sistemas de reciclaje de nutrientes llevan en esas naves para que pueda sobrevivir un astronauta durante unos 20 años. O cómo en un mundo postapocalíptico con escasez de recursos, todavía existe la NASA con un pedazo megaproyecto que ríase usted del proyecto Apolo (*). No, con lo que me voy a atrever es con el motivo por el cual los seres humanos se ven obligados a realizar un viaje interestelar a través de un agujero de gusano: la plaga que está acabando con todas las cosechas de la Tierra.
- Oye Chris
- ¿Qué, John?
- Cómo justificamos un proyecto de viaje espacial en un mundo postapocalíptico en el que hay escasez de recursos
- Fácil, el calentamiento global producido por la guerra global acaba con todas las cosechas.
- ¡Buff! Demasiado trillado. Tiene que ser algo más original
- Un asteroide
- ¿Estás de broma?
- Una pandemia mortal
- ¡Venga ya!
- ¡Ya lo tengo! una plaga que acabe con todas las plantas comestibles
- ¿Con todas? ¿No es un poco exagerado?
- Bueno, podemos dejar un par que aguanten un poco. Por ejemplo, el maíz. Era la base de la alimentación de los pioneros americanos. Y también algo exótico y africano como la okra. Pero luego también se verán afectadas
- Pero no hay ninguna plaga capaz de hacer eso.
- Pues nos la inventamos. La llamaremos "The Blight", como aquella que afectaba a las patatas en Irlanda.
- Sí vale, pero ¿a todas?
- A ver, ¿qué necesitan todas las plantas para crecer, además de agua, suelo y sol?
- Déjame pensar... ¿Fertilizante?
- ¿Y qué llevan los fertilizantes?
- ¿Nitrógeno?
- Muy bien.
- Pero el nitrógeno es muy abundante. Es el 78% por ciento de la atmósfera.
- Pues hacemos que "The Blight" pueda ser capaz de respirar nitrógeno y ¡ahí lo tienes!
- ¡Genial!
O bien los asesores científicos contratados por los hermanos Nolan no se leyeron esa parte del guión o yo no entiendo como les dejaron meter esa morcilla. Veamos, el nitrógeno de la atmósfera es un gas diatómico (N2). Los dos átomos de nitrógeno están unidos por un triple enlace (N≡N) extremadamente fuerte. Eso es precisamente lo que hace que el nitrógeno gaseoso sea un gas inerte (termino que significa incapaz de reaccionar). Pero esto se supone que es Ciencia-Ficción así que, como "respirar" significa que los seres vivos combinan el oxígeno de la atmósfera (O2) con las moléculas orgánicas para producir CO2 y H2O, a lo mejor los hermanos Nolan simplemente quieren decir que ha aparecido un tipo de ser vivo capaz de hacer reaccionar el N2 con el O2.
¿Puede ser posible eso? El nitrógeno molecular reacciona, pero cuesta un montón de energía romper ese triple enlace. En la Naturaleza sucede gracias a los rayos o a los seres vivos, más concretamente, gracias a los microorganismos fijadores del nitrógeno. Todos esos microorganismos son procariotas y gastan unos 24 ATPs en fijar una simple molécula de nitrógeno y transformarla en dos moléculas de amonio. Nosotros aprendimos a hacerlo de manera artificial en 1895 gracias a Adolph Frank y Nikodem Caro. El proceso lo mejoró Fritz Haber y Carl Bosch en 1902. A partir de ese momento, se pudieron fabricar fertilizantes basados en formas de nitrógeno bioasimilables (amonios, nitritos y nitratos).
Generalmente, en el último año de instituto se suele enseñar el llamado "ciclo del nitrógeno en la Biosfera". Este ciclo se suele repasar y ampliar en diversas asignaturas de carreras de ciencias, como es el caso de las asignaturas de Microbiología. En la siguiente ilustración se detalla el ciclo:
 |
| Ciclo biológico del Nitrógeno. Todos los procesos y transformaciones indicadas son mediadas por seres vivos. Fuente: Nature |
En ese ciclo aparecen todos las transformaciones que sufre el nitrógeno gracias a la acción de los seres vivos. Fijémonos en donde está la molécula de N2 (si el ciclo es un reloj, está a las 4). Todas las demás rutas del ciclo acaban en el N2 gaseosa y de ahí sólo parte una flecha roja. La molécula de N2 sólo se transforma en NH3 (flecha roja) gracias al proceso biológico conocido como fijación del nitrógeno. Es un proceso que se produce en condiciones anaerobias, y en ese proceso la molécula de nitrógeno es reducida a dos moléculas de amoniaco. Químicamente, la reacción se expresa de esta forma:
Una vez que el nitrógeno está en forma de amoniaco (o de amonio) ya se puede usar por los seres vivos, que generalmente lo incorporan en los aminoácidos. De manera muy simplificada podríamos decir que el resto de moléculas que aparecen en ese ciclo podrían ser consideradas como formas bioasimilables, pero el nitrógeno gaseoso no lo es. Fijémonos también en otra cosa. No hay ningún ser vivo que sea capaz de hacer reaccionar el N2 con el O2.
¿Y por qué no pueden existir algún ser vivo que "respire" nitrógeno? ¿Es qué acaso no pueden reaccionar el N2 y el O2 para formar algún tipo de óxido de nitrógeno? Sí lo pueden hacer, lo malo es que es una reacción endotérmica que necesita unos 1600 ºC para que se produzca. Por eso, ese tipo de compuestos sólo se forman en la atmósfera cuando hay rayos. Pero dudo mucho que exista alguna vez un ser vivo que le de por gastar una cantidad descomunal de energía en una reacción que no le sirve para nada.
 |
| Reacciones abióticas que suceden en la atmósfera entre el nitrógeno, el agua y el oxígeno gracias a la energía de los rayos. Fuente: PEOI. Para más detalles Rakov, Vladimir A.; Uman, Martin A. (2007). Lightning: Physics and Effects. Cambridge University Press. Clickear encima para ver con detalle. |
En resumen ¿qué demonios significa que la plaga de "Interstellar" sea capaz de respirar nitrógeno? Pues en mi opinión algo similar a decir que un objeto puede viajar a la velocidad de la luz. Así que la película puede que merezca un 8,9 en Física Relativista, pero a mi humilde entender, en Biología y Química saca un suspenso.
(*) Parece ser que la catástrofe dejo intacta a la NASA y a sus científicos, pero eliminó selectivamente a todos los biólogos/químicos/ingenieros agrónomos o cualquier otro ser humano capaz de intentar abordar el problema de crear una variedad de planta resistente a una plaga vegetal. Algo que llevamos haciendo desde que se conoce la agricultura. En viajes espaciales tenemos mucha menos experiencia, y muchísima menos gente especialista en los mismos. Generalmente, un proyecto de investigación en patógenos vegetales puede costar unos cuantos milloncejos de euros. Así que resulta llamativo que en un mundo con tanta escasez de recursos se dediquen la inmensa mayoría de ellos a realizar una serie de viajes espaciales en los que los astronautas pueden hibernar y tienen recursos alimentarios casi infinitos y no sean capaces de intentar desarrollar un vegetal comestible resistente a una plaga.
Esta entrada participa en el XLII Carnaval de Química alojado en el blog Ciencia en el XXI, y en el LVIII Carnaval de la Física alojado en MasScience. En el de Biología no puede participar porque este mes no hay :(
Otros enlaces de interés:
Los aciertos y errores de Interstellar
Luces y sombras de Interstellar
jueves, 23 de octubre de 2014
El plátano transgénico que no le gusta a la bacteria amarilla
 |
| Fotografía de microscopía electrónica de barrido de la bacteria patógena vegetal Xanthomonas oryzae pv. oryzicola invadiendo el estoma de una hoja de la planta del arroz. Las Xanthomonas inyectan en las células unas proteínas que se unen al DNA vegetal activando la transcripción de determinados genes que favorecen la infección de la planta. Fuente: Science. |
En el año 1961 los investigadores D. Yirgou y JF. Bradbury consiguieron aislar la bacteria Xanthomonas campestris patovar musacearum. Dicho así no parece muy llamativo, pero esa bacteria es la causante de la marchitez del ensete o falso bananero de Etiopía. En esta planta lo que se come no es el fruto, sino la raíz, y ésta puede llegar a pesar unos 40 kilos. Así que no es de extrañar que sea una planta de interés agronómico en esa zona de África tan frecuentemente devastada por hambrunas. De ahí la importancia de identificar a la bacteria que causaba su destrucción.
 |
| Ensete de Etiopía. Fuente: Wikipedia |
Pero los problemas causados por la Xanthomonas no habían hecho nada más que empezar. En el año 2001 una enfermedad desconocida comenzó a hacer estragos en las plantaciones de bananas de Uganda. Comenzaba con un amarilleamiento de las hojas jóvenes seguido de su marchitez. Los tejidos internos de la planta se decoloraban y los frutos se pudrían a gran velocidad. En tan sólo tres años la enfermedad se extendió de tal manera que acabó con entre un tercio y el 50% de la producción de plátanos en la zona de Uganda central. No fue hasta el año 2004 en el que un grupo de científicos ugandeses identificó al culpable de dicha plaga.
 |
| Aspecto del interior del tallo de una banana afectada por X. campestris. Todo el exudado está cargado de bacterias. Fuente: Plantwise |
Como se habrán imaginado, se trataba de Xanthomonas campestris pv musacearum. No se entiende muy bien como llegó de Etiopia a Uganda y otros países cercanos, aunque según los datos genéticos parece que lo hizo de dos maneras distintas.La bacteria se transmite de planta a planta de varias maneras: la más frecuente es por insectos ya que las plantas putrefactas atraen a multitud de ellos. La bacteria coloniza las superficies de esos insectos y de esa manera llega a otras plantas. Otra forma de transmisión era por los cuchillos y machetes usados por los agricultores para la recolección de los frutos. Y para empeorar las cosas, X. campestris también puede colonizar los suelos agrícolas y permanecer latente en ellos durante largos períodos de tiempo.
 |
| Análisis genéticos de los brotes de la marchitez de los bananos y su relación con los genotipos de X. campestris en Etiopía. Los resultados parecen indicar que el patógeno fue introducido en dos eventos independientes. Fuente: Wasukira et al. 2012. Genes |
Hasta hace unos años la única forma de combatir la expansión de la plaga era destruir por completo las plantaciones de bananos donde aparecieran plantas afectadas y luego esperar un año o más para que la bacteria desapareciera del suelo. Afortunadamente en el año 2010 un grupo ugandés liderado por Leena Tripati tuvo una idea bastante buena para luchar contra la plaga: crear bananas resistentes a la infección por Xanthomonas. Y para eso lo primero que hicieron fue mirar que plantas eran resistentes naturales a la infección por Xanthomonas. Es es el caso del pimiento (Capsicum annuum). La causa de dicha resistencia es la acción combinada de dos genes. Por un lado el gen Hrap y por otro el Pflp. Lo que hace el primero es matar a las células que rodean a las células infectadas. Es decir, actúa como una especie de cortafuegos que confina a la infección. El segundo gen codifica para una proteína que produce una gran cantidad de especies reactivas del oxígeno, lo que suele acabar con las bacterias y además incrementar la respuesta hraP. A continuación, el grupo de Tripatii creo una banana transgénica que contenía el gen Hrap del pimiento y comprobaron que efectivamente, era resistente a la infección por Xanthomonas. En el 2012 crearon la banana transgénica que contenía el gen Pflp y también comprobaron que era resistente a la infección. Las bananas trangénicas no mostraban ninguna diferencia tanto en morfología como en propiedades organolépticas de sus frutos con respecto a las bananas no transgéncias. Y los productos de los genes Hrap y Pflp no están listados como posibles alergenos por lo que no son potencialmente peligrosas para la salud humana (además de en el pimiento, ambos genes también están presentes en el arroz). En cuanto a otros aspectos de bioseguridad. Las plantas de banana comestibles son estériles solo se pueden propagar de manera clonal, por lo que el riesgo de "contaminación genética" es mínimo.
Pero quedaba por hacer lo más importante, porque una cosa es que una planta transgénica sea resistente a la infección en el laboratorio o en invernaderos controlados y otra muy distinta es que lo sea en condiciones agrícolas. Y eso es precisamente lo que se ha publicado recientemente en la revista Nature Biotechnology. Los investigadores han hecho una prueba en el campo escogiendo 65 líneas transgénicas: 40 líneas expresando el gen Hrap y 25 con el gen Pflp que mostraban una alta resistencia en el laboratorio. Y han comprobado que un 20% de las líneas que contienen el gen Hrap y un 16% de las líneas que contienen el gen Pflp presentaban un 100% de resistencia a la infección por parte de X. campestris en condiciones agrícolas.
 |
| Resultado de las pruebas de campo con plantas de banano transgénicas resistentes a la infección por X. campestris y no transgénicas a: Planta transgénica sin síntomas. b: Planta no transgénica mostrando síntomas de marchitamiento. c: Planta no transgénica con una infección sistémica. d: Interior del tallo de una planta transgénica. e: Interior de los frutos de una planta transgénica. f: Interior del tallo de una planta no transgénica. la mucosidad amarilla es la savia de la planta completamente invadida por X. campestris. e: Interior de los frutos de una planta no transgénica. h: Aspecto externo de los frutos de una planta transgénica. i: Aspecto externo de los frutos de una planta no transgénica. Origen de la imagen: Tripathi et al. 2014 Nature Biotechnology. |
Lo siguiente que se han planteado hacer es ampliar estos estudios en condiciones ambientales y geográficas diferentes. También quieren comprobar la persistencia de la resistencia en dichas plantas transgénicas y por supuesto, evaluar la capacidad de evolución de X. campestris por si es capaz de "romper" la resistencia a la infección. De hecho, para minimizar ese riesgo, están ya intentando producir líneas transgénicas de bananas que lleven los dos genes.
Hay que tener en cuenta que el cultivo de la banana es una importante fuente de ingresos para los países de la región de los Grandes Lagos y del África Oriental. Además, en Uganda, Rwanda y Burundi el consumo de banana constituye al menos 30% de la ingesta de calorias por persona. Así que estas plantas transgénicas pueden suponer un gran beneficio, sobre todo si tenemos en cuenta que será distribuido gratuitamente entre los agricultores de la zona.
Esta entrada participa en la XXXIII edición del Biocarnaval que hospeda @CEAmbiental en el blog Consultoría y Educación Ambiental
jueves, 25 de septiembre de 2014
Campos magnéticos para diagnosticar la malaria
 |
| Izquierda: Muestra de sangre en el que puede observarse un trofozoíto en el interior de un glóbulo rojo (origen de la imagen: Wikipedia). Derecha: ciclo del Plasmodium en el interior de los glóbulos rojos (Fuente de la imagen: CDC) |
No es de extrañar que haya mucho interés en desarrollar un método rápido, barato y sencillo para diagnosticar la malaria. Como es lógico más de un grupo ha intentado desarrollar algún kit de diagnóstico basado en algún tipo de técnica de Biología Molecular o en un ensayo inmunológico. Pero todos los desarrollados hasta el momento son caros y no tan sensibles como se esperaba. El umbral de detección está en torno a los 100 trofozoítos por microlitro, el doble de los niveles detectables por un buen técnico. Afortunadamente la Física y la Química han venido en ayuda de la Microbiología Clínica.
En el año 2012 un grupo búlgaro liderado por I. Kezsmarki describió un método basado en la detección de un metabolito generado por el parásito cuando digiere a los glóbulos rojos desde dentro. Los hematíes son fundamentalmente bolsas de hemoglobina, y P. falciparum la digiere para así obtener aminoácidos. Al destruir la hemoglobina, se libera el grupo hemo acomplejado con el hierro. Pero el grupo hemo es un compuesto bastante tóxico que podría destruir al parásito. Así que lo que hace P. falciparum es transformarlo en hemozoína, un compuesto insoluble que precipita formando unos cristales cilíndricos de color marrón debido al hierro que contienen.
 |
| A: Estructura de la hemozoína. Los grupos hematina interaccionan entre sí gracias a una serie de enlaces de hidrógeno formando una estructura cristalina. B: Cristal de hemozoína producido por P. falciparum. C: Cristales de hemozoína bajo la luz polarizada. D: Un glóbulo rojo invadido por P. falciparum. En la parte de la izquierda puede observarse un cuerpo residual de color marrón que está compuesto por cristales de hemozoína. Fuente de las imágenes: Wikipedia |
Los investigadores bulgaros pensaron acertadamente que dichos cristales debían de comportarse como unos pequeños imanes y que podrían ser detectados mediante el uso de un campo magnético. Cuando la sangre de un infectado por malaria se ponía bajo la acción de un campo magnético oscilante, estos cristales comenzaban a girar y se ordenaban sobreponiéndose a las perturbaciones térmicas. Además, estos cristales son anisotropos, por lo que actúan como unos polarizadores de la luz, lo cual permite que se puedan detectar de manera bastante precisa . Ventaja de este procedimiento: se detectaban hasta 10 trofozoítos por microlitro. Desventaja: se necesitaba un aparato de Espectroscopía de Resonancia Magnética Nuclear (la conocida como NMR) tremendamente cara y grande acompañada de un técnico entrenado.
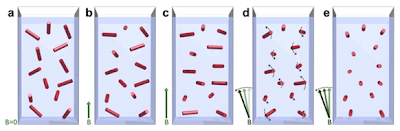 |
| Cristales de hemozoína sometidos a un campo magnético oscilante. En (a) los cristales están en suspensión y el campo magnético es nulo (B=0). Si se les somete a un campo magnético (b y c), los cristales se alinean, pero debido a las fluctuaciones térmicas el alineamiento se acaba perdiendo. Si se hace oscilar el campo magnético (d y e) los cristales de hemozoína comienzan a rotar, con lo que se consigue contrarrestar el efecto de las fluctuaciones térmicas y al final los cristales quedan alineados. Fuente de la imagen: Butikay et al. Scientific Reports |
Pero ahora el grupo liderado por Jongyoon Han, del Singapore-MIT Alliance for Research and Technology Centre ha desarrollado un método para analizar una muestra tan pequeña como 10 microlitros de sangre, para el que no se necesita ningún técnico superentrenado y que no necesita un equipamiento excesivamente caro. En el año 2010 Ralph Weissleder y Hakho Lee consiguieron fabricar un equipo NMR mucho más pequeño y barato y basándose en su experiencia el gruo de Han han conseguido diseñar un equipo en miniatura de Relaxometría de Resonancia Magnética (MRR por sus siglas en inglés). La MRR es un tipo de NMR (sí, parece un trabalenguas). Adicionalmente, la técnica de detección desarrollada permite detectar a la hemozoína en muestras de sangre sin necesidad de procesarlas y a unos niveles de hasta 10 trofozoítos por microlitro, mucho antes de que el paciente empiece a mostrar algún síntoma por lo que se puede empezar a tratar de manera temprana. Eso es muy importante si tenemos en cuenta que los países afectados por la malaria suelen ser países en vías de desarrollo con recursos y personal muy limitados.
 |
| Sistema portátil de Relaxometría por Resonancia Magnética desarrollado por Weng Kung Peng, Lan Chen y Jongyoon Han. Pesa unos 250 gramos y sus dimensiones son de 16 x 9 cm. El campo magnético de 0,76 Teslas es generado por unos imanes del tamaño de una moneda. Origen de la imagen: MIT |
¿Cuáles son los "peros"? en primer lugar todavía es una técnica experimental. Se ha probado con muestras de ratón y con el parásito cultivado en condiciones de laboratorio. Se tiene que realizar un test en condiciones reales con un gran número de muestras clínicas. Quizás factores como la genética o la dieta del paciente podrían afectar al resultado. También está descrito que hay casos clínicos en los que los niveles de hemozoína no son muy elevados por lo que quizás la enfermedad no sería detectada. De todas formas, está claro que es un avance significativo.
Este blog participa en la XLII Edición del carnaval de la Física alojado en High Ability Dimension, en la XXXIX edición del carnaval de la Química alojado en Gominolas de petróleo y en la XXXII edición del Biocarnaval alojado en Scykness.
Butykai, A., Orbán, A., Kocsis, V., Szaller, D., Bordács, S., Tátrai-Szekeres, E., Kiss, L., Bóta, A., Vértessy, B., Zelles, T., & Kézsmárki, I. (2013). Malaria pigment crystals as magnetic micro-rotors: key for high-sensitivity diagnosis Scientific Reports, 3 DOI: 10.1038/srep01431
Skinner, N. (2014). Quick test for malaria shows promise Nature DOI: 10.1038/nature.2014.15796
Peng, W., Kong, T., Ng, C., Chen, L., Huang, Y., Bhagat, A., Nguyen, N., Preiser, P., & Han, J. (2014). Micromagnetic resonance relaxometry for rapid label-free malaria diagnosis Nature Medicine, 20 (9), 1069-1073 DOI: 10.1038/nm.3622
domingo, 29 de junio de 2014
Aspergilomarasmina A: una vieja conocida, una nueva amiga.
En 1965 unos investigadores franceses describieron una molécula asociada a la marchitez de las hojas producida por un hongo de la especie Aspergillus flavus. Bautizaron a esa fitotoxina como Aspergilosmarasmina A (AMA para abreviar). En los años 80 se estudió su potencial como sustancia inhibidora de la enzima convertidora de angiotensina y en los 90 como una molécula capaz de inhibir la activación enzimática de la endotelina, sin embargo en ambos casos no se llegó a a la fase final de producirla como medicamento.
La aspergilosmarasmina A actuaba como inhibidor de las enzimas que debían de procesar a la angiotensina y a la endotelina. Ambas enzimas son de la familia de las metaloproteasas, la misma familia a la que pertenecen las metalobetalactamasas como NDM-1. Así que alguien pensó que si la aspergillomarasmina inhibía a unas, bien podía inhibir a las otras. Y si eso era así, quizás podría utilizarse como un adyuvante para tratar infecciones provocadas por bacterias resistentes a los antibióticos betalactámicos (de manera semejante a lo que se hace con el ácido clavulánico y la ampicilina).
 |
| (a) Estructura de la Aspergillomarasmina A (AMA) (b) Actividad inhibitoria de la AMA sobre las betametalolactamasas NDM-1 (cuadrados negros) y VIM-2 (círculos blancos). Los cuadrados negros indican que la actividad de la serin-carbapenemasa OXA-48 no se ve afectada por AMA (fuente: King et al. Nature) |
Y eso es precisamente lo que han hecho en el grupo de investigadores canadienses liderado por Gerard D. Wright y que ha sido publicado recientemente en la revista Nature. Han comprobado que la AMA inhibe de manera irreversible a las betalactamasas NDM-1 y VIM-2, pero no es activa frente a otras carbapenemasas. A continuación, lo que hicieron fue comprobar si esta molécula podía darse en combinación con un antibiótico. La AMA es muy efectiva contra las metalobetalactamasas, pero no es un antibiótico por lo que no mata a las bacterias. Lo que se hizo fue combinar el antibiótico meropenem con AMA y comprobar si el cóctel era efectivo frente a diferentes cepas bacterianas conocidas por ser portadoras de resistencias a los antibióticos betalactámicos.
 |
| Diversos patógenos Gram negativos portando resistencias a los betalactámicos fueron enfrentados a una combinación de meropenem y AMA. Todos aquellos que portaban las resitencias NDM y VIM fueron sensibles (barras rojas y azules). Los que portaban las resistencias AIM, IMP y SPM-1 no. (Fuente: King et al. Nature) |
Pero una cosa es que en un ensayo in vitro esa combinación funcione y otra muy distinta es que pueda ser usada como una posible terapia frente a una infección. Y por eso el siguiente paso fue utilizar un modelo animal. En primer lugar los investigadores utilizaron ratones a los que se les inyectó intraperitonealmente una dosis subletal de la cepa N11-2218 de Klebsiella pneumoniae. Esta cepa es resistente al antibiótico meropenem. Luego dividieron a los ratones en tres grupos: el grupo control al que sólo se le inyectó suero salino, un segundo grupo con ratones que sólo serían tratados con meropenem, y finalmente otro con ratones a los que se les administraría meropenem más AMA. Posteriormente analizaron la cantidad de bacterias presentes en bazo (spleen) y en hígado (liver). Se observó una reducción de diez veces en el número de bacterias presentes en ambos órganos. Pero todavía faltaba por ver si el antibiótico era efectivo frente a una infección grave. Así que en el siguiente experimento utilizaron ratones a los que se les inyecto una dosis letal de K. pneumoniae. En este caso los ratones fueron divididos en cuatro grupos: control con suero salino, tratados sólo con una inyección de meropenem, tratados sólo con una inyección de AMA y tratados con una inyección de la combinación de meropenem más AMA. En este último grupo, todos los ratones sobrevivieron menos uno (95% de supervivencia).
 |
| Efecto de la combinación antibiótico meropenem más AMA en el tratamiento de infecciones experimentales en ratones. En las gráficas de arriba se muestra el nivel de bacterias en bazo y en hígado. En la parte de abajo se muestra el porcentaje de supervivencia (ver el texto para más detalles. Fuente King et al. Nature) |
¿Qué es lo que va a pasar ahora? Los resultados son muy prometedores porque permiten vislumbrar una forma de alargar la efectividad de diversos antibióticos frente a las cada vez más frecuentes resistencias bacterianas. El estudio de la AMA puede servir como base para desarrollar nuevas moléculas que inhiban a las enzimas responsables de inactivar a los antibióticos. Pero hay un largo camino que recorrer hasta que la AMA llegue a las farmacias, si es que llega. Primero hay que determinar si los niveles en los que la AMA puede ser usada en combinación con los antibióticos no afectan a la función de las enzimas que regulan la angiotensina y la endotelina lo que podría provocar cambios indeseables en la presión sanguínea de los pacientes. Y seguidamente hay que empezar a diseñar los ensayos clínicos para probar que efectivamente esta estrategia es efectiva en humanos. Pero está claro que el redescubrimiento de la aspergilomarasmina A es una buena noticia.
Esta entrada participa en el XXXVI Carnaval de la Química (Edición Kr) alojado en Café de Ciencia y en el XXXI Carnaval de la Biología alojado en Retales de Ciencia
King, A., Reid-Yu, S., Wang, W., King, D., De Pascale, G., Strynadka, N., Walsh, T., Coombes, B., & Wright, G. (2014). Aspergillomarasmine A overcomes metallo-β-lactamase antibiotic resistance Nature, 510 (7506), 503-506 DOI: 10.1038/nature13445
lunes, 19 de mayo de 2014
Polizones del espacio
 |
| El selfie de la Curiosity. (Nature) |
Parece que la panespermia puede ser cierta, pero en sentido contrario. Según podemos leer en la revista Nature la sonda Curiosity podría haber llevado consigo unos cuantos polizones microbianos terrícolas que ahora estarían en Marte.
Las sondas espaciales son esterilizadas antes de ser enviadas a explorar otros planetas. Hasta ahora se pensaba que los procedimientos empleados eran suficientes para asegurar que ningún microorganismo terrícola pudiera viajar de polizón en una sonda. También se pensaba que cualquier microorganismo que escapara esos procedimientos probablemente no sobreviviría al largo viaje interplanetario y al intenso calor de la entrada en la atmósfera del planeta a explorar. Pero un trabajo presentado en el último congreso de la ASM parece indicar que quizás no sea así. Los microbios son mucho más duros de lo que se pensaba.
Los investigadores tomaron muestras de las diferentes superficies de la Curiosity incluyendo el escudo térmico y el sistema de vuelo antes de su lanzamiento hacia el Planeta Rojo. Encontraron 377 cepas pertenecientes a 65 especies bacterianas. Un 11% de ellas eran capaces de aguantar condiciones de alta radiación UV, frío y sequedad extrema, pHs muy ácidos o muy básicos. Muchas de ellas pertenecían al género Bacillus, conocido por su capacidad de producir endosporas altamente resistentes. Pero también han encontrado otros microorganismos capaces de aguantar esas condiciones extremas sin necesidad de estructuras de protección, sino que lo hacen mediante cambios en su metabolismo.
 |
| ¿Habrá llegado a Marte? Bacillus subtilis con una endospora (Science Photo Library) |
Según la microbióloga Stephanie Smith, líder del grupo investigador, todavía no saben con seguridad si realmente se ha producido dicha contaminación, pero en su opinión la NASA debería extremar las precauciones en sus procedimientos de esterilización. En el año 2011 se informó de que uno de los aparatos que portaba la sonda no había sido esterilizado convenientemente. Sobre todo con vistas a la misión que se quiere lanzar en el año 2020 y en la que la sonda a emplear sería capaz de enviar a la Tierra unas muestras de suelo marciano. No haría mucha gracia encontrar que dichas muestras se hubieran contaminado con microorganismos polizones terrícolas.
Esta entrada participa en la edición XXX carnaval de la Biología alojada en Activa tu neurona y en el LII carnaval de la Física que aloja el blog La Enciclopedia Galáctica.
lunes, 12 de mayo de 2014
La revolución CRISPR/Cas
Ni CRISPR es el nombre de una nueva marca de aperitivo crujiente ni Cas es el nombre de un refresco para acompañarlo. La primera palabreja es el acrónimo de Clustered Regularly Interspaced Short Palindromic Repeats, que en español significa "Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Interespaciadas". La segunda es el nombre de una serie de proteínas, principalmente unas nucleasas, que las llamaron así por CRISPR associated genes (es decir: "genes asociados a CRISPR". No se rompieron la cabeza). Dicho así tampoco es que se aclaren mucho las cosas ¿no? Y sin embargo es posible que estemos contemplando el desarrollo de una tecnología genética que va a suponer una auténtica revolución comparable a la que supuso la famosa PCR (Reacción en Cadena de la Polimerasa) para las Ciencias Biológicas.
Vamos intentar describir lo que es CRISPR/Cas en una sola frase: es el sistema inmune de las bacterias. ¡Espere! No deje de leer todavía. No es tan descabellado como parece. En los vertebrados, incluidos los seres humanos, el sistema inmune es el conjunto de células y órganos encargados de defender al organismo de las infecciones provocadas por bacterias o virus. No es exclusivo de los vertebrados, ya que otro tipo de animales como los insectos, crustáceos, moluscos, incluso esponjas, también tienen un sistema inmune, aunque mucho más simple. Pero las bacterias son seres unicelulares, entonces ¿cómo puede tener una bacteria un "sistema inmune"?
Las bacterias también pueden ser infectadas, por ejemplo por virus. Ya hemos comentado en otros artículos anteriores que un virus es un pirata de la célula. Los virus que infectan bacterias son llamados bacteriófagos, o simplemente fagos. Los más simples están compuestos de un ácido nucleico que puede ser DNA o RNA como material genético, y de una envoltura proteica denominada cápside. De manera muy simple el ciclo biológico de un fago es el siguiente: el virus se une a la bacteria gracias a su cápside y le inyecta su ácido nucleico. Una vez dentro el ácido nucleico viral toma el control de las funciones celulares, sobre todo del proceso de biosíntesis de proteínas. A partir de ese momento, la bacteria sólo replica el material genético viral y sintetiza proteínas virales. Según se van acumulando en el interior de la célula se van ensamblando los nuevos virus, hasta que al final la bacteria revienta (se lisa) y los nuevos virus son liberados.
 |
| Ciclo lítico de un fago. Origen de la imagen: Biología Médica |
Está claro que a una bacteria le interesaría tener alguna forma de neutralizar a un virus que se mete en su interior (o cualquier otro DNA extraño, como el de un plásmido). Una forma de hacerlo es tener unas enzimas que sean capaces de distinguir entre el material genético de la bacteria y entre el material genético vírico, y una vez hecha la distinción, destruir al material genético del virus. Esas enzimas se descubrieron en la segunda mitad del siglo XX y se le conoce como el sistema de restricción/modificación: las que destruyen el DNA foráneo se las denomina enzimas de restricción, y las que reconocen y modifican el DNA propio para que no sea destruido se las llama enzimas de modificación. Las primeras sobre todo son una de las herramientas más importantes dentro de la ingeniería genética. Pero hay otra forma de neutralizar a un virus que infecta a una bacteria: el sistema CRISPR/Cas.
La historia tuvo su origen cuando se comenzó a mapear los genomas completos de bacterias y otros microorganismos. Se esperaba que unos seres vivos tan pequeños tuvieran su información genética muy compactada en el DNA. Y en general es así. Pero también había sorpresas (sorpresas que fueron descifradas por el microbiólogo Francis Mojica). Una zona del genoma de muchos microorganismos, sobre todo arqueas, estaba llena de unas secuencias que parecían repeticiones palindrómicas sin ninguna función aparente. Estas repeticiones estaban separadas entre si mediante unas secuencias denominadas "espaciadores" que se asemejaban a secuencias encontradas en virus y en plásmidos. Justo delante de esas repeticiones y "espaciadores" hay una secuencia que se la denomina "líder". Muy cerca de este agrupamiento se podían encontrar unos genes que codificaban para un tipo de nucleasas: los genes cas.
 |
Estructura del locus CRISPR(A) Las secuencias repetidas de unos 32 pares de bases (gris oscuro) están intercaladas por las secuencias "espaciadoras" (colorines). El número de estas secuencias puede variar enormemente entre diferentes cepas bacterianas de la misma especie.(B) La secuencia conservda "líder" (en gris claro) de unos cuantos cientos de pares de bases está delante del agrupamiento de repeticiones y espaciadores (C) Los genes cas están cercanos al locus CRISPR. Se muestran la estructura de dicho locus en tres especies bacterianas como ejemplo. Fuente de la imagen: Karginov FV y Hannon GJ. Mol Cell 2010 |
Vamos a intentar explicar esta situación con una analogía. Supongamos que el genoma de la bacteria es como un libro de instrucciones. Imaginemos que ese libro se titula "Haga una Escherichia coli en 1000 fáciles lecciones". Las secuencias CRISPR sería como encontrar 50 páginas en las que sólo leyéramos decenas de frases palindrómicas como estas: "Daba la zorra arroz al abad", "¿Acaso hubo búhos acá?", "La ruta nos aportó otro paso natural", y esas frases separadas entre sí por una serie de textos que parecerían sacados de otros libros titulados "Cómo hacer un fago" o "Cómo hacer un plásmido". A primera vista pensaríamos que esas páginas contienen información sin sentido y que se trata de un error de imprenta. Pero si encontráramos que todos los ejemplares de otros libros dedicados a Streptococcus pyogenes o Pyrococcus furiosus contienen ese mismo tipo de páginas, entonces empezaríamos a pensar que deberían servir para algo.
Volvamos a los virus. Como hemos dicho antes esos seres son piratas de la célula. Siguiendo con la analogía del libro, un virus sería como una página suelta que si es capaz de integrarse en un libro, entonces se fotocopia de manera que acaba ocupando todas las páginas de ese libro. Es como si pusiéramos dentro de un ejemplar de "El Quijote" una página de las memorias de Belén Esteban y al final en lugar de la obra de Cervantes acabamos con un tocho de hojas de la teletertuliana. Pues bien, si esa página-virus se integra en un libro que contiene las páginas de palíndromos lo que observaríamos es que esa página-virus no se fotocopia, sino que es destruida. Son precisamente esas páginas que no parecen tener sentido las encargadas de dicha protección.
De manera muy simplificada, a nivel molecular lo que está ocurriendo es lo siguiente. Cuando el material genético del virus entra dentro de la bacteria debe de tomar el control de la maquinaria celular y para ello empieza a interaccionar con diversos componentes celulares. Pero puede darse el caso que interaccione con un complejo formado por una proteína Cas unida al RNA producido a partir de las secuencias CRISPR. Si ocurre eso, resulta que el material genético viral es inactivado y posteriormente degradado. Pero el asunto no se queda ahí. Las proteínas Cas hacen otra cosa además de destruir el material genético del virus. Resulta que son capaces de tomar una pequeña parte del DNA viral, modificarlo e integrarlo dentro del conjunto de secuencias CRISPR. De esa forma, si esa bacteria o su descendencia se encuentra con ese mismo virus, ahora inactivará de forma mucho más eficiente al material genético viral.
 |
Funcionamiento del sistema CRISPR/Cas. Un virus ha introducido su DNA en la bacteria. A ese DNA se le ha unido un complejo que consiste en un tipo de proteína Cas (verde) que lleva unido un pequeño crRNA ("cr" por CRISPR). Esa unión inactiva al DNA viral y así puede ser degradado. El pequeño crRNA proviene del procesamiento de un crRNA de mayor tamaño por parte de otro tipo de proteína Cas (azul). Ese RNA es el producto de la transcripción de todas las secuencias CRISPR presentes en el genoma de la bacteria. En paralelo a la inactivación del DNA viral, otro tipo de proteínas Cas (rojo) reconocen al DNA viral y a partir de él crean un pequeño segmento que integraran en las secuencias CRISPR, de esa forma la bacteria formará complejos crRNA/Cas mucho más eficientes en su unión al DNA viral en caso de una nueva infección por el mismo virus. Imagen realizada a parir de material de la Wikipedia y del artículo Karginov FV y Hannon GJ. Mol Cell 2010 . |
Recapitulemos. El llamado "sistema inmune de las bacterias" es simplemente un mecanismo por el cual se reconoce genoma viral, se inactiva y se destruye, al mismo tiempo que una parte de ese genoma viral se incorpora al genoma de la bacteria para así generar una protección más eficiente. Esto es el típico resultado de lo que llamamos Ciencia Básica. La humanidad ha adquirido un nuevo avance en el conocimiento sobre cómo funciona el mundo. ¡Bravo! ¡Estupendo! Pero, y esto, ¿para qué sirve?
Esa es la típica pregunta que se hace cualquier miembro de la sociedad. Y como científicos no debemos olvidar que lo que hacemos suele estar pagado con los impuestos del sufrido ciudadano, así que hay que rendirles cuentas y demostrarles que el conocimiento en ciencia básica puede que no tenga una aplicación útil inmediata, pero que la puede tener en el futuro, y ser tan importante que cambie por completo sus vidas y la de sus hijos. Eso es lo que sucedió antes con la internet, con el horno microondas y con los test para detectar enfermedades genéticas. Y también está pasando con el sistema CRISPR/Cas.
Como hemos visto antes, una de las cosas que hace el sistema CRISPR/Cas es introducir DNA de un organismo, el virus, en el DNA de otro organismo, la bacteria. Y lo hace con una precisión absoluta. Es el mejor sistema que conocemos para realizar esa integración. En relación con los sistemas anteriores que se utilizaban en ingeniería genética sería como comparar un serrucho con una sierra eléctrica. No es de extrañar que la revista Nature le dedicara una portada a la proteína Cas9 (puede verse arriba) ¿Y este sistema no podría usarse con otros organismos? Pues la respuesta es sí. El sistema CRISPR/Cas puede ser utilizado para introducir cualquier tipo de DNA en el DNA de cualquier tipo de ser vivo, sean estos bacterias, setas, plantas, insectos, peces, ratones, monos e incluso seres humanos (esto último aún no se ha hecho). Es decir, el sistema CRISPR/cas va camino de convertirse en una herramienta que nos va a permitir por ejemplo hacer terapia génica con gran precisión y así tratar enfermedades como la hemofilia o la enfermedad de Huntington.
 |
Funcionamiento de la enzima Cas9. Esta nucleasa tien dos sitios activos que pueden romper cada una de las cadenas de una doble hélice de DNA. La enzima es guiada a una secuencia concreta de DNA que queremos cortar gracias a unas secuencias denominadas PAM (por las siglas en inglés de motivos adyacentes a los protoespaciadores) y que pueden ser sintetizadas a medida en el laboratorio. La molécula de DNA puede ser vuelta a ligar gracias a los sistemas de reparación. Pero si hay presente un DNA dondador homólogo a la secuencia que ha sido cortada entonces puede introducirse por recombinación homóloga y de esa forma realizar un inserción genética dirigida tanto en bacterias, líneas célulares de mamíferos, o embriones de pez zebra. Origen de la imagen: Emmanuelle Charpentier y Jennifer A. Doudna. Nature 2013. |
Y los primero pasos ya se han dado. El Instituto Technológico de Massachuset anunció el pasado 30 de marzo que había conseguido curar a un ratón adulto de una enfermedad hepática de carácter genético utilizando el sistema CRISPR/Cas. Los ratones estaban afectados de tirosinemia de tipo I, una enfermedad en el que el gen que codifica la que la enzima fumarilacetoacetato hidrolasa (FAH) no funciona por una mutación. Esta enzima se encuentra en los hepatocitos, las células del hígado, y si no funciona entonces el aminoácido tirosina no se degrada correctamente por lo que se acumula fumarilacetoacetato, lo que acaba causando fallos en el hígado y en los riñones. Esta enfermedad también se da en humanos, su incidencia es de 1 entre 100.000 nacimientos y puede provocar retraso mental, problemas hepáticos graves e incluso la muerte. Hay un tratamiento paliativo a base de una dieta baja en proteínas y administrando nitisinona. Otra posibilidad es realizar un trasplante hepático.
Lo que hicieron los investigadores fue inyectar en una vena de los ratones a la proteína Cas-9 con un segmento de RNA unido a otro pequeño segmento de DNA. La función del segmento de RNA es indicar a la proteína Cas-9 dónde tenía que cortar en el gen FAH dentro del genoma de las células de ratón. La función del segmento de DNA era integrarse en ese gen y sustituir la mutación deletérea por la secuencia correcta del gen FAH. La inserción y sustitución sólo funcionó en 1 de cada 250 hepatocitos, pero esas células ya eran normales y sanas. Y mientras las portadoras de la mutación se morían por el acúmulo de fumarilacetoacetato, las sanas las iban remplazando. En 30 días un tercio de todas las células de los hígados de los ratones tratados eran células curadas y los roedores podían sobrevivir sin tratamiento.
 |
| Los ratones Fahmut/mut portan una mutación homocigótica en la que una Guanina ha sido sustituida por una Adenina en el último nucleótido del exon 8. Esta mutación causa que el exon 8 sea removido durante el procesamiento del mRNA del gen Fah lo que da lugar a una proteína totalmente inactiva (representado por los segmentos debajo de la secuencia). Lo que se hace es inyectar proteína Cas9 junto con un crRNA diseñado para ser dirigido al lugar donde está la mutación y un DNA de cadena sencilla (ssDNA) que porta la secuencia correcta. En las microfotografías de la parte inferior puede verse una tinción de hematoxilina-eosina (H&E) de secciones del hígado provenientes de ratones tratados después de 30 días. Al la izquierda se ve la de un ratón sin la mutación (Fah+/+, un ratón Fahmut/mut al que se le ha inyectado ssDNa y Cas9 sin el crARN-guía y el , y un ratón Fahmut/mut al que se le ha inyectado ssDNA y Cas9 con el crRNA-guía. En las microfotografías superiores la barra representa 100 μm y en las inferiores 20 μm . Nótese la aparición de células sanas que aparecen en el ratón tratado con Cas9 guiado. Fuente de la imagen: Yin et al. Nature Biotechnology 2014. |
Este es sólo un ejemplo de los muchos trabajos que se están realizando con este sistema. Según la revista Nature Biotechnology, en el último año y medio se han publicado más de 125 artículos científicos y se han fundado tres compañías biotecnológicas dedicadas a comercializar y mejorar este sistema. El último mes, las Universidades de California de San Francisco (UCSF) y de Berkeley (UCB), y la Fundación Li Ka Shing habían invertido 12 millones de dólares en la creación de la Iniciativa de Innovación Genómica (IGI) dedicada a acelerar la adopción de esta tecnología. No está mal como aplicación de un descubrimiento de Ciencia Básica realizado en bacterias en el año 1987.
Esta entrada participa en la edición XXX carnaval de la Biología alojada en Activa tu neurona y en la edición Br (XXXV) del carnaval de la Química alojada en Ciencia para todos
Karginov, F., & Hannon, G. (2010). The CRISPR System: Small RNA-Guided Defense in Bacteria and Archaea Molecular Cell, 37 (1), 7-19 DOI: 10.1016/j.molcel.2009.12.033
Shen, H. (2013). CRISPR technology leaps from lab to industry Nature DOI: 10.1038/nature.2013.14299
Charpentier, E., & Doudna, J. (2013). Biotechnology: Rewriting a genome Nature, 495 (7439), 50-51 DOI: 10.1038/495050a
Yin, H., Xue, W., Chen, S., Bogorad, R., Benedetti, E., Grompe, M., Koteliansky, V., Sharp, P., Jacks, T., & Anderson, D. (2014). Genome editing with Cas9 in adult mice corrects a disease mutation and phenotype Nature Biotechnology DOI: 10.1038/nbt.2884
viernes, 2 de mayo de 2014
Paleovirología de la viruela
 |
| El antropólogo forense Scott Warnasch examina el cadáver accidentalmente desenterrado en Queens, New York. Se puede ver los restos del ataúd de metal. Todavía no sabían que esa persona había muerto de viruela. Origen de la imagen: Sara Reardon, Nature 2014 |
En el año 2011 se estaban poniendo los cimientos para una construcción en el barrio neoyorquino de Queens cuando los obreros realizaron un macabro descubrimiento: un ataúd de hierro con unos restos humanos en su interior. Inicialmente se pensó en que era la víctima de un crimen, pero posteriormente se estableció que en realidad debería ser alguien que fue enterrado en el cementerio de una parroquia cercana hacia mediados del siglo XIX. Se trataba de una mujer negra que vestía camisón y calcetines. Pero lo que más llamó la atención a los investigadores era que había sido enterrada en un ataúd de hierro, un auténtico lujo para la época que le tocó vivir. Ese ataúd había permitido que los restos se conservaran en bastante buen estado.
 |
| Detalle de la piel del cadáver de la mujer desenterrada en Queens. Se pueden observar los restos de las pústulas en su frente. Origen de la imagen: McCollum et al. Emerging Infectious Diseases 2014. |
Al examinar el cuerpo los forenses observaron que había una serie de lesiones y de granos diseminados por todo el cuerpo. Esas lesiones y granos recordaron a Bradley Adams, el jefe de antropología forense de Nueva York, las pústulas que había visto en fotos de enfermos de viruela. Los forenses se dieron cuenta que el ataúd de hierro no era un lujo, en realidad era un contenedor para evitar que la infección se diseminara. Inmediatamente la zona de obras fue clausurada y se llamó al CDC de Atlanta para que clausurara e investigara los restos. La epidemióloga Andrea McCollum y su equipo fueron enviados a Queens y aunque suponían que era muy poco probable que hubiera algún virus activo en dichos restos se tomaron muestras para analizarlas. Los análisis confirmaron que había DNA del virus, pero estaba tan degradado que no había partículas virales activas.
 |
| Momia de Ramses V. Se supone que los granos que se observan en su rostro son restos de las pústulas de viruela. Origen de la imagen: Sara Reardon, Nature 2014 |
Lo cierto es que no sería la primera vez que se han encontrado restos humanos con viruela. El cadáver más famoso en el que pueden apreciarse presencia de pústulas corresponde a la momia del faraón Ramses V, enterrado hace 3200 años. Cuando se tomaron muestras de la piel y se analizaron usando técnicas inmunológicas se encontró una pequeña reacción con anticuerpos frente a la viruela. Se piensa que es posible que el virus podría estar preservado si los restos se mantienen a baja temperatura. Durante la campaña de erradicación de la viruela se observó que el virus era muy estable si permanecía en el tejido humano. Cuando una pústula revienta, la sangre se coagula en el lugar y las proteínas fibrosas del coagulo forman un denso entramado atrapando al virus. Esas costras envejecidas eran las que se utilizaban para realizar la variolación, el precedente de la vacunación. En 1968, un grupo holandés publicó sus resultados sobre la supervivencia del virus de la viruela en costras recolectadas desde 1950 y guardadas en sobres. Comprobaron que el virus seguía activo a los 13 años, cuando se les terminaron las costras. El experimento demostró que el virus de la viruela podía sobrevivir por más de una década en un clima templado.
¿Y en un clima frío? En el año 2004 un equipo de antropólogos estaba explorando la región siberiana de Yakutia. Encontraron una tumba con cinco cuerpos momificados y congelados dentro de un ataúd de madera. Los cuerpos parecían pertenecer todos a la misma familia y todo indicaba a que murieron súbitamente a comienzos del siglo XVIII. En el mejor preservado de todos ellos encontraron restos de DNA del virus y aunque estaba muy degradado la secuencia que se obtuvo mostró que era una cepa distinta a la que circuló en Asia y Europa durante el siglo XX.
 |
| Momias siberianas de la región de Yakutia enterradas en un ataúd de madera y de las que se pudo extraer DNA del virus de la viruela suficiente para realizar un análisis filogenético. En el dendrograma puede verse que el DNA de Siberia (PoxSib) es bastante distinto del obtenido de diversas cepas del siglo XX (se indica el lugar y el año de aislamiento, por ejemplo Tanz65 es Tanzania 1965). Origen de la imagen: Biagini et al. NEJM 2012. |
Supongo que en la próxima asamblea que va a celebrar la OMS para discutir si se destruyen los stocks de viruela que se mantienen en los congeladores del CDC de Atlanta y de los laboratorios VECTOR en Rusia continuarán con su decisión de seguir manteniéndolos. Lo cierto es que hay un cierto temor a que en alguna ocasión se pueda desenterrar a este virus, pero más miedo existe a que alguien mantenga en secreto algún stock del virus o que alguien intente aprovechar la secuencia genética del virus, publicada en 1990, para reconstruirlo. Y esos stocks son los únicos que hay disponibles para poder realizar nuevas vacunas o probar nuevos antivirales.
Esta entrada participa en la XXX edición del Carnaval de la Biología alojado en el blog Activa tu neurona
Wolff HL, & Croon JJ (1968). The survival of smallpox virus (variola minor) in natural circumstances. Bulletin of the World Health Organization, 38 (3), 492-3 PMID: 4299528
Biagini, P., Thèves, C., Balaresque, P., Géraut, A., Cannet, C., Keyser, C., Nikolaeva, D., Gérard, P., Duchesne, S., Orlando, L., Willerslev, E., Alekseev, A., de Micco, P., Ludes, B., & Crubézy, E. (2012). Variola Virus in a 300-Year-Old Siberian Mummy New England Journal of Medicine, 367 (21), 2057-2059 DOI: 10.1056/NEJMc1208124
McCollum, A., Li, Y., Wilkins, K., Davidson, W., Paddock, C., Karem, K., Reynolds, M., & Damon, I. (2012). Poxvirus viability and signatures in historical relics International Journal of Infectious Diseases, 16 DOI: 10.1016/j.ijid.2012.05.224
Reardon, S. (2014). Infectious diseases: Smallpox watch Nature, 509 (7498), 22-24 DOI: 10.1038/509022a






