|
| Anaqueles de una farmacia (origen de la imagen) |
Cuando se habla de "reposicionamiento de fármacos" (drug repositioning) no nos estamos refiriendo a ordenar de manera distinta las pomadas, jarabes y pastillas que se pueden encontrar en los anaqueles de una farmacia. Consiste en utilizar un fármaco ya existente para tratar una enfermedad distinta para la que fue originalmente desarrollado. El reposicionamiento tiene una ventaja nada desdeñable. Como el fármaco ya se utiliza, eso significa que ha pasado una serie de ensayos clínicos por las distintas agencias regulatorias del medicamento como la EFSA o la FDA y que su seguridad para su uso clínico está certificada, por lo que lo único que queda por hacer es demostrar que ese fármaco es realmente efectivo contra la nueva patología, algo que abarata muchísimo los costes y aligera los trámites. Esto es especialmente interesante en el caso de la búsqueda de nuevos antibióticos. A pesar de la actual crisis por el incremento de infecciones por bacterias resistentes a los antimicrobianos, muchas compañías farmacéuticas no invierten en el desarrollo de nuevas moléculas debido a su poco atractivo económico. E incluso algunas de las más grandes están abandonando la investigación en dicho campo.
Ya hemos hablado antes de la bacteria patógena Streptococcus pneumoniae y de los diferentes esfuerzos que se están haciendo para combatir a este patógeno. Bueno, pues ahora le ha llegado el turno de probar con el reposicionamiento de fármacos. Se ha usado una colección de moléculas denominada Prestwick® Chemical Library que contiene 1200 moléculas con licencia de uso farmacológico y en las cuales la patente ha expirado. Los 1200 compuestos fueron usados a una concentración de 50 micromolar y 0,5% DMSO en cultivos del neumococo dispuestos en placas de 96 pocillos. Tras cuatro horas de cultivo se observó la densidad óptica de los pocillos. En 161 cultivos se observó una disminución de la turbidez mayor del 60% comparados con el cultivo control que solo contenía DMSO al 0,5%. En la figura inferior esos compuestos están representados por todos los círculos que superan la línea horizontal. A continuación, se seleccionaron aquellos compuestos que eran capaces de provocar una disminución del 50% de la densidad óptica del neumococo en cualquier fase de crecimiento. De esa forma se descartaron nueve compuestos y quedaron 152 que fueron clasificados según su actividad descrita anteriormente en la bibliografía (gráfico circular de la derecha en la imagen inferior) De ellos, 121 fueron descartados pues ya habían sido descritos como fármacos con potencial antibacteriano (círculos grises en la gráfica de la izquierda). Los 31 compuestos restantes pertenecían a diferentes categorías farmacológicas y no habían sido descrito como compuestos antimicrobianos (círculos rojos en la gráfica de la izquierda).
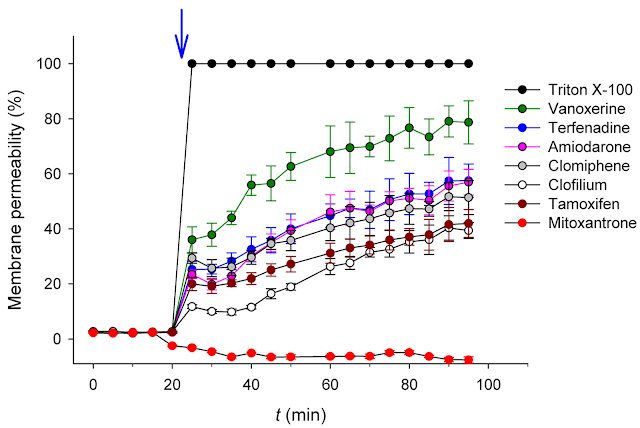
Salta a la vista que seis de ellos tienen un parecido estructural evidente por lo que posiblemente su mecanismo de acción sea muy parecido. Esos seis compuestos son aminas terciarias/cuaternarias alifáticas con un anillo fenólico y con un marcado carácter hidrofóbico. Estos compuestos presentan carga positiva a pH fisiológico, lo que unido a su hidrofobicidad podría indicar que su mecanismo de acción fuera a través de la perturbación de la membrana celular neumocócica a través de la interacción iónica con la cabeza polar cargada negativamente de los fosfolípidos, junto con la interacción hidrofóbica con las cadenas de ácidos grasos. Para comprobar dicha hipótesis se realizó un ensayo que consistía en añadir cada uno de los compuestos a un cultivo de neumococo en presencia de la sonda fluorescente SYTOX Green. Si la membrana de la bacteria está intacta, el fluoróforo permanece fuera de la célula y no hay fluorescencia. Pero si la membrana está dañada, el fluoróforo entra y se une al DNA con lo que las células presentan una fluorescencia verde muy marcada. Como control positivo se utilizó el detergente Tritón X-100, que permeabiliza totalmente a las células. En la siguiente figura tenemos los resultados (la flecha indica el momento en el que se añade el compuesto).
¿Cuál es el siguiente paso? Una opción puede ser estudiar si hay efectos sinérgicos entre estas moléculas o con otros antibióticos ya descritos. Otra es intentar modificarlas para conseguir nuevos compuestos con mejores propiedades antibacterianas. Lo cierto es que tenemos que seguir estudiando para evitar que el aumento de las resistencias provoque que nos quedemos sin antibióticos en un futuro que esperemos sea lejano.
Artículo:
Laura Ortiz-Miravalles, Manuel Sánchez-Angulo, Jesús M. Sanz y Beatriz Maestro. Drug Repositioning as a Therapeutic Strategy against Streptococcus pneumoniae: Cell Membrane as Potential Target. International Journal of Molecular Sciences. 2023, 24(6), 5831; https://doi.org/10.3390/ijms24065831.